
 Entrer le plate-forme Sexage de Oiseaux
Entrer le plate-forme Sexage de Oiseaux
Sexage de Oiseaux basé sur le DNA
Depuis plus de 10 ans, nous sommes experts dans le sexage des oiseaux par extraction de l'ADN sur la base d'échantillons de sang, de plumes ou d'œufs. Dans notre laboratoire de pointe spécialisé en Biologie Moléculaire, nous avons déjà testé plus de 1000 espèces d'oiseaux jusqu'à présent et nous continuons à développer notre expertise. Si vous ne savez pas comment collecter vos échantillons, regardez notre page Comment Collecter page.
Pour définir le sexe de votre oiseau, vous pouvez choisir de nous envoyer soit:- Échantillons de sang
- Échantillons de plumes
- Echantillons d'œufs
Vous recevez les résultats dans 48 heures (jours de travail) de la réception de l’échantillon d’oiseaux à la délivrance du certificat où vous pouvez changer online le nom de propriétaire si nécessaire.
Si vous ne savez pas comment collecter vos échantillons, regardez notre comment collecter page. Si vous ne savez pas comment passer une commande, regarder notre comment commander page.
Pourquoi choisir STAB VIDA?- ISO 9001 certifiée
- Résultats disponibles dans 48 heures (jours de travail)
- Qualité assurée, les résultats sont toujours vérifiés
- Certificat électronique gratuit, téléchargeable et imprimable
- Certificat sur papier spécial avec timbre également disponible
- La création de votre espace personnel sur notre site web vous permet de suivre l'état de tous vos échantillons
- carte d’identification d'oiseau personnalisée GRATUITE
- Service personnel, chat en ligne disponible
- Aucune intervention chirurgicale telle que des anesthésiques n'est nécessaire
- Applicable aux oiseaux de tout âge, n'importe le moment de l'année
- Les oiseaux ne sont pas soumis au stress du transport
- Méthode fiable applicable à la plupart des espèces
Dans le laboratoire de STAB VIDA, des experts travaillent tous les jours les sexage des oiseaux. Le sexage d’oiseau c’ est un service qui exige une précision consciencieuse, une responsabilité et une base scientifique solide. Nos experts avec plus de 10 ans d'expérience dans le domaine de l'ADN animal travaillent dans notre laboratoire de pointe spécialisé en biologie moléculaire. La méthode d'identification sexuelle des oiseaux par l'ADN est basée sur les différentes compositions des chromosomes sexuels des oiseaux entre les mâles et les femelles. Le mâle a deux chromosomes sexuels égaux: le chromosome Z. D'autre part, la femelle en a deux différentes: les chromosomes Z et W. Les chromosomes Z et W ont des tailles différentes permettant d'observer différentes liaisons entre les deux sexes. Par conséquent, la distinction entre le mâle et la femelle devient effective: le mâle possède une seule bande (correspondant à deux chromosomes Z), tandis que les femelles ont deux bandes (correspondant aux chromosomes Z et W).
Resultats de l’ analyse d'adn d'oiseau
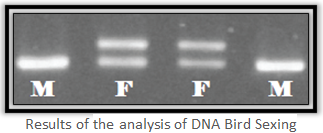
La grand base de données de l'ADN, présente dans STAB VIDA, permet toujours de comparer chaque résultat avec des oiseaux de la même espèce et de sexe connu.
Liste des Espèces
Notre liste d'espèces d'oiseaux continue de croître! Vous trouverez ci-dessous la liste des espèces aviaires que nous avons testées jusqu'à présent.
Est-ce que votre espèce d'oiseau n'est pas sur notre liste?
Étape 1. Envoyez-nous un échantillon principal d'un oiseau de la même espèce, de préférence d'une oiseau femelle.
Étape 2. Envoyez-nous les échantillons des oiseaux que vous voulez savoir le résultat.
Il n'y a pas de coûts supplémentaires en plus de la détermination de sexage de votre oiseau!
N'hésitez pas à nous contacter si vous avez besoin d'aide supplémentaire!
| Nom Scientific |
|---|
| Aburria cumanensis |
| Accipiter nisus |
| Accipter gentilis |
| Acridotheres cristatellus |
| Acridotheres Fuscus |
| Acridotheres ginginianus |
| Acridotheres tristis |
| Acryllium vulturinum |
| Aegypius monachus |
| Agapornis |
| Agapornis fischeri |
| Agapornis lilianae |
| Agapornis nigrigenis |
| Agapornis personatus |
| Agapornis roseicollis |
| Agapornis taranta |
| Alauda arvensis |
| Alectoris chukar |
| Alectoris graeca |
| Alisterus amboinensis |
| Alisterus scapularis |
| Amazona aestiva |
| Amazona aestiva aestiva |
| Amazona aestiva xanthopteryx |
| Amazona albifrons |
| Amazona amazonica |
| Amazona auropalliata |
| Amazona autumnalis |
| Amazona autumnalis lilacina |
| Amazona autumnalis mexicana |
| Amazona barbadensis |
| Amazona brasiliensis |
| Amazona cubano |
| Amazona dufresniana |
| Amazona farinosa |
| Amazona farinosa guatemalae |
| Amazona festiva |
| Amazona festiva bodini |
| Amazona finschi |
| Amazona leucocephala |
| Amazona muller |
| Amazona ochrocephala |
| Amazona ochrocephala panamensis |
| Amazona oratrix |
| Amazona oratrix tresmariae |
| Amazona parvipes |
| Amazona pretrei |
| Amazona rhodocorytha |
| Amazona tresmariae |
| Amazona tucumana |
| Amazona ventralis |
| Amazona vinacea |
| Amazona viridigenalis |
| Amazona xanthops |
| Anodorhynchus hyacinthinus |
| Anthropoides virgo |
| Aplopelia larvata |
| Aprosmictus erythropterus |
| Ara ararauna |
| Ara ararouca |
| Ara auricollis |
| Ara chloroptera |
| Ara couloni |
| Ara glaucogularis |
| Ara hyacinthinus |
| Ara macao |
| Ara maracana |
| Ara militaris |
| Ara nobilis |
| Ara rubrugena |
| Ara severus |
| Aramides ypecaha |
| Arara Jacinta |
| Arara-catalina |
| Aratinga acuticaudata |
| Aratinga aurea |
| Aratinga auricapilla |
| Aratinga auropalliata |
| Aratinga canicularis |
| Aratinga erythrogenys |
| Aratinga finschi |
| Aratinga jandaya |
| Aratinga leucophthalma |
| Aratinga mitrata |
| Aratinga nanday |
| Aratinga pertinax |
| Aratinga rubritorquis |
| Aratinga solstitialis |
| Aratinga wagleri |
| Aratinga weddellii |
| Arborophila gingica |
| Ardeola speciosa |
| Argusianus argus |
| Astrild cyanocephale |
| Athene noctua |
| Balearica pavonina |
| Balearica regulorum |
| Barnardius barnardi |
| Barnardius zonarius |
| Barnardius zonarius semitorquatus |
| Boissonneaua jardini |
| Bolborhynchus lineola |
| Bombycilla cedrorum |
| Bostrychia hagedash |
| Branta leucopsis |
| Brotogeris sanctithomae |
| Brotogeris tirica |
| Brotogeris versicolurus |
| Bucorvus leadbeateri |
| Burhinus oedicnemus |
| Cacatua alba |
| Cacatua ducorpsii |
| Cacatua galah |
| Cacatua galerita |
| Cacatua galerita eleonora |
| Cacatua goffini |
| Cacatua leadbeateri |
| Cacatua Moluccensis |
| Cacatua sanguinea |
| Cacatua sulphurea |
| Cacatua sulphurea citrinocristata |
| Cacatua sulphurea parvula |
| Cacatua tenuirostris |
| Caloenas nicobarica |
| Caloenas nicobarica |
| Calyptorhynchus banksii |
| Carduelis atrata |
| Carduelis carduelis |
| Carduelis chloris |
| Carduelis cucullatus |
| Carduelis flammea |
| Carduelis flavirostris |
| Carduelis hornemanni |
| Carduelis magellanica |
| Carduelis major |
| Carduelis spinus |
| Carduelis tristis |
| Cariama cristata |
| Caropsis migra |
| Carpodacus mexicanus |
| Catreus wallichii |
| Chaetura meridionalis |
| Chaetura meridionalis |
| Chalcophaps chrysochlora |
| Chalcophaps indica |
| Chalcopsitta atra |
| Chalcopsitta cardinalis |
| chalcopsitta duivenbodei |
| Chalcopsitta scintillata |
| Chalcopsitta scintillata rubrifons |
| Charadrius hiaticula |
| Charmosyna papou goliathina |
| Chauna torquata |
| Chloris chloris |
| Ciconia nigra |
| Cinnyricinclus leucogaster |
| Cochlearius cochlearius |
| Colius striatus |
| Columba arquatrix |
| Columba corensis |
| Columba guinea |
| Columba larvata |
| Columba larvata |
| Columba livia |
| Columba maculosa |
| Columba maculosa albipennis |
| Columba minuta |
| Columba oenas |
| Columba oenops |
| Columba palumbus |
| Columba picazuro |
| Columba picturata |
| Columbina cruziana |
| Columbina squammata |
| Columbina talpacoti |
| Conur mandayus menday |
| Coracias cyanogaster |
| Coracias garrulus |
| Coracias naevieus |
| Coracopsis nigra |
| Coracopsis vasa |
| Coracya cyanogaster |
| Coragyps atratus |
| Corvus albus |
| Corvus corax |
| Coscoroba coscoroba |
| Cosmopsarus regius |
| Cossypha niveicapilla |
| Creatophora cinerea |
| Crossoptilon auritum |
| Crossoptilon crossoptilon |
| Crossoptilon mantchuricum |
| Cyanocompsa brissonii |
| Cyanocompsa brissonni |
| Cyanoliseus patagonus |
| Cyanopica cyanus |
| Cyanoramphus novaezeleandiae |
| Cygnus atratus |
| Cygnus melanocoryphus |
| Cygnus olor |
| Dacelo novaeguineae |
| Dendrocopos major |
| Dendrocygna arborea |
| Deroptyus accipitrinus |
| Dinemellia dinemelli |
| Diopsittaca nobilis |
| Diuca diuca |
| Dromaius novaehollandiae |
| Ducula pistrinaria |
| Ducula rosacea |
| Ducula spilorrhoa |
| Duteo buteo |
| Egretta novaehollandiae |
| Elanus caeruleus |
| Emblema guttata |
| Eolophus roseicapillus |
| Eos bornea |
| Eos reticulata |
| Eos squamata obiensis |
| Erithacus rubecula |
| Erythrura cyaneovirens |
| Erythrura gouldiae |
| Erythrura Psittacea |
| Erythrura trichroa |
| Estrilda caerulescens |
| Estrilda melpoda |
| Estrilda rhodopyga |
| Estrilda troglodytes |
| Eudocimus albus |
| Eudocimus ruber |
| Eudromia elegans |
| Falco femoralis |
| Falco peregrinus |
| Falco rusticolus |
| Falco vespertinus |
| Forpus coelestis |
| Forpus xanthopterygius |
| Galinholas |
| Gallicolumba criniger |
| Gallicolumba luzonica |
| Gallicolumba rufigula |
| Gallicolumba tristigmata |
| Garrulax canorus |
| Garrulus glandarius |
| Geopelia cuneata |
| Geopelia humeralis |
| Geopelia maugei |
| Geopelia placida |
| Geopelia striata |
| Geophaps lophotes |
| Geotrygon versicolor |
| Geotrygon versicolor |
| Geronticus calvus |
| Geronticus eremita |
| Gibber italicus |
| Goura cristata |
| Goura victoria |
| Goura victoria |
| Gracula religiosa |
| Gracula religiosa |
| Grus vipio |
| Guarouba guarouba |
| Guttera pucherania pucherania |
| Gymnorhina tibicen |
| Gyps fulvus |
| Haliaeetus leucocephalus |
| Hieraaetus pennatus |
| Himantopus himantopus |
| Himantopus mexicanus |
| Ixobrychus minutus |
| Lamprotornis caudatus |
| Lamprotornis chalybaeus |
| Lamprotornis chloropterus |
| Lamprotornis iris |
| Lamprotornis purpureus |
| Lamprotornis regius |
| Lamprotornis splendidus |
| Lamprotornis superbus |
| Lathamus discolor |
| Leiothrix lutea |
| Leptotila rufaxilla |
| Leptotila verreauxi |
| Leucopsar rothschildi |
| Leucosarcia melanoleuca |
| Lonchura atricapilla |
| Lonchura bicolor |
| Lonchura castaneothorax |
| Lonchura cucullata |
| Lonchura griseicapilla |
| Lonchura maja |
| Lonchura malabarica |
| Lonchura malabarica |
| Lonchura malacca |
| Lonchura molluca |
| Lonchura nevermani |
| Lonchura striata domestica |
| Lophocroa leadbeateri |
| Lophophorus impeyanus |
| Lophospingos pusillus |
| Loris Arco-Iris |
| Loris fuscata |
| Loris mitchell |
| Loris molucanos |
| Loris reticulata |
| Lorius chlorocercus |
| Lorius garrulus |
| Lorius hypoinochrous |
| Lorius lory |
| Lybius dubius |
| Melopsittacus undulatus |
| Merops apiaster |
| Metriopelia ceciliae |
| Mino dumontii |
| Monticola saxatilis |
| Musophaga rossae |
| Musophaga violacea |
| Mycteria ibis |
| Myiopsitta monachus |
| Nandayus nenday |
| Neochmia ruficauda |
| Neochmia temporalis |
| Neophema bourkii |
| Neophema chrysostoma |
| Neophema elegans |
| Neophema pulchella |
| Neophema splendida |
| Neophema tourquoisine |
| Neopsephotus bourkii |
| Nitycorax nitycorax |
| Northiella haematogaster |
| Numida meleagris |
| Nymphicus hollandicus |
| Ocyphaps lophotes |
| Oena capensis |
| Onychognathus morio |
| Oratrix magna |
| Oreortyx pictus |
| Oriolus oriolus |
| Orthopsittaca manilatus |
| Oryzoborus crassirostris |
| Otus scops |
| Padda fuscata |
| Padda oryzivora |
| Parabuteo unicinctus |
| Paroaria capitata |
| Paroaria coronata |
| Paroaria dominicana |
| Parus caeruleus |
| Passerina ciris |
| Passerina cyanea |
| Pauxi pauxi |
| Pavo cristatus |
| Phapitreron leucotis nigrorum |
| Phaps chalcoptera |
| Pica pica |
| Piezorinha cinerea |
| Pinicola Enucleator |
| Pionites leucogaster |
| Pionites leucogaster xanthomerius |
| Pionites melanocephala |
| Pionopsitta pileata |
| Pionus chalcopterus |
| Pionus fuscus |
| Pionus maximiliani |
| Pionus menstruus |
| Pionus senilis |
| Pipile cumanensis |
| Platycercus adelaideae |
| Platycercus adscitus |
| Platycercus caledonicus |
| Platycercus elegans |
| Platycercus eximius |
| Platycercus flaveolus |
| Platycercus icterotis |
| Platycercus pallicep |
| Platycercus venustus |
| Plegadis falcinellus |
| Podargus strigoides |
| Poephila acuticauda |
| Poephila bichenovili. |
| Poephila cincta |
| Poephila personata |
| Poicephalus cryptoxanthus |
| Poicephalus gulielmi |
| Poicephalus jardine |
| Poicephalus meyeri |
| Poicephalus Robustus |
| Poicephalus rueppellii |
| Poicephalus Rufiventris |
| Poicephalus senegalus |
| Polyplectron bicalcaratum |
| Polyplectron chalcurum |
| Polyplectron germaini |
| Polyplectron inopinatum |
| Polyplectron napoleonis |
| Polytelis alexandrae |
| Polytelis anthopeplus |
| Polytelis swainsonii |
| Porphyrio porphyrio |
| Primolius couloni |
| Primolius Maracana |
| Propyrrhuna couloni |
| Propyrrhura auricollis |
| Psephotus chrysopterygius chrysopterygius |
| Psephotus dissimilis |
| Psephotus haematogaster |
| Psephotus haematonotus |
| Pseudeos fuscata |
| Psilopsiagon Aymara |
| Psittacara holochlorus |
| Psittacula alexandri |
| Psittacula cyanocephala |
| Psittacula derbiana |
| Psittacula eupatria |
| Psittacula himalayana |
| Psittacula krameri |
| Psittacula roseata |
| Psittacus erithacus |
| Psittacus erithacus erithacus |
| Psittacus erithacus princeps |
| Psittacus erithacus timneh |
| Psitteuteles goldie |
| Psitteuteles iris |
| Pternistis erckelii |
| Pteronetta hartlaubii |
| Ptilopachus petrosus |
| Ptilopsis leucotis |
| Puffinus pacificus |
| Pulsatrix perspicillata |
| Purpureicephalus spurius |
| Pycnonotus cafer |
| Pycnonotus jocosus |
| Pycnonotus leucogenys |
| Pycnonotus leucotis |
| Pyrrhula pyrrhula |
| Pyrrhura aurea |
| Pyrrhura cruentata |
| Pyrrhura egregia |
| Pyrrhura egregia |
| Pyrrhura emma |
| Pyrrhura frontalis |
| Pyrrhura griseipectus |
| Pyrrhura hypoxantha |
| Pyrrhura lepida |
| Pyrrhura leucotis |
| Pyrrhura melanura |
| Pyrrhura molinae |
| Pyrrhura molinae cinnamon |
| Pyrrhura molinae hypoxantha |
| Pyrrhura molinae pineapple |
| Pyrrhura perlata |
| Pyrrhura picta |
| Pyrrhura picta |
| Pyrrhura rhodocephala |
| Pyrrhura rhodogaster |
| Pyrrhura roseifrons |
| Pyrrhura rupicola |
| Pyrruhura leucogaster |
| Ramphastos sulfuratos |
| Ramphastos toco albogularis |
| Rosela platycercus eximius |
| Sarcops calvus |
| Senegal |
| Serinus atrogularis |
| Serinus atrogularis |
| Serinus atrogularis somereni |
| Serinus canaria |
| Serinus dorsostriatus |
| Serinus hypostictus |
| Serinus leucopygius |
| Serinus mozambicus |
| Serinus reichenows |
| Serinus striolatus |
| Serinus sulphuratus |
| Sicalis flaveola |
| Sittasomus griseicapillus |
| Spreo superbus |
| Stagonopleura guttata (or Emblema guttata) |
| Streptopelia capicola |
| Streptopelia chinensis |
| Streptopelia decaocto |
| Streptopelia decipiens |
| Streptopelia lugens |
| Streptopelia picturata |
| Streptopelia roseogrisea |
| Streptopelia semitorquata |
| Streptopelia senegalensis |
| Streptopelia turtur |
| Strix leptogrammica |
| Strix nebulosa |
| Struthio camelus |
| Sturnus pagodarum |
| Sturnus sinensis |
| Sturnus unicolor |
| Sturnus vulgaris |
| Taeniopygia guttata |
| Tangara cyanicollis |
| Tauraco erythrolophus |
| Tauraco fischeri |
| Tauraco hartlaubi |
| Tauraco leucolophus |
| Tauraco leucotis |
| Tauraco livingstonii |
| Tauraco persa buffoni |
| Tauraco Persa Persa |
| Tauraco porphyreolophus |
| Tauraco schalowi |
| Thalassornis leuconotus |
| Theristicus caudatus |
| Theristicus melanopis |
| Threskiornis spinicollis |
| Tockus erythrorrinchus |
| Tockus flavirostris |
| Tordo dissimilis |
| Trachyphonus darnaudii |
| Tragopan caboti |
| Treron calva |
| Treron wallia |
| Trichoglossus capistratus |
| Trichoglossus chlorolepidotus |
| Trichoglossus euteles |
| Trichoglossus haematodus |
| Trichoglossus haematodus haematodus |
| Trichoglossus haematodus caeruleiceps |
| Trichoglossus haematodus capistratus |
| Trichoglossus haematodus micropteryx |
| Trichoglossus haematodus mitchellii |
| Trichoglossus haematodus moluccanus |
| Trichoglossus haematodus moluccanus |
| Trichoglossus haematodus ornatus |
| Trichoglossus haematodus rubritorqui |
| Trichoglossus iris |
| Trichoglossus ornatus |
| Trichoglossus rubritorquis |
| Turdus iliacus |
| Turdus merula |
| Turdus philomelos |
| Turdus viscivorus |
| Turtur abyssinicus |
| Turtur afer |
| Turtur brehmeri infelix |
| Turtur chalcospilos |
| Tyto alba |
| Upupa epops |
| Uraenghitus angolensis |
| Urocissa erythrorhyncha |
| Vanellus armatus |
| Vanellus chilensis |
| Vanellus coronatus |
| Vanellus miles |
| Vanellus miles |
| Vanellus vanellus |
| Vini australis |
| Zenaida asiatica |
| Zenaida auriculata |
| Zenaida aurita |
| Zenaida graysoni |
Comment Collecter
| Plumes | Sang | Coquille d’œuf |
|---|---|---|
|
- Commander a kit de collection gratuit ou téléchargé & imprimez nos ‘Imprimez vous-Même’ kit
- Lavez-vous les mains avec l'alcool avant de collecter l'échantillon afin d'éviter contamination - Lorsque vous collectez des échantillons de plusieurs oiseaux, lavez-vous les mains avec l'alcool entre échantillons d'oiseaux différents - Ne pas toucher les plumes après avoir été prélevé - Prélevez 4-5 plumes de taille moyenne en phase initial de croissance (de préférence), c'est-à-dire, quand les plumes commencent à émerger du calamus (Fig.4). Après avoir arrachez la plume, évitez le contacte directe de la région du calamus de la plume avec les mains, car c’est à la base que se trouve l’ADN - Après le prélèvement, les plumes doivent être placées dans l’espace pour coller vos plumes dans le ‘Imprimez vous-Même’ kit ou devrait être placé dans un sac stérile (fig.2) du STAB VIDA Kit - Les échantillons prélevés doivent être envoyés à STAB VIDA le plus rapidement possible (maximum 5 jours après le prélèvement). |
- Commandez un kit de collection STAB VIDA gratuit pour le sang ou utilisez le papier du ‘Imprimez vous-Même’ kit
- Afin d'éviter la contamination de vos échantillons, s'il vous plaît, lavez-vous les mains avec de l'alcool avant de prélever vos échantillons - Quand vous prélever vos échantillons de plusieurs oiseaux lavez-vous les mains avec l'alcool Entre le prélèvement d'échantillons d'oiseaux différents. Évitez le contact avec les plumes après le prélèvement - Ne pas toucher le sang après avoir été prélevé - Couper l’ongle de l’oiseau (fig.3) - déposer 2 à 3 gouttes de sang dans le cercle du ‘Imprimez vous-Même’ kit - Vous pouvez également collecter environ 0,1 ml de sang de chaque oiseau à l'aide d'une seringue stérile (utiliser une seringue pour chaque oiseau) Tube: - Recueillir dans le tube avec de l'alcool (fig.1) fourni dans le kit Papier: - Lorsque vous utilisez papier, placez tout le sang dans le même endroit au centre du papier - Les échantillons prélevés doivent être envoyés à STAB VIDA le plus rapidement possible (maximum 5 jours après le prélèvement) |
Commander Kit de collection gratuit
- Lavez-vous les mains avec l'alcool avant de collecter l'échantillon afin d'éviter contamination - Ne pas toucher les coquilles d'œufs après les collecter - Recueillir la coquille d’œuf entière de l'oiseau (fig.5) dont le sexe doit être déterminé, dans les premières 24 heures après l'éclosion - Mettez la coquille d'œuf dans le tube avec de l'alcool (fig.1) fourni dans le kit - Les échantillons prélevés doivent être envoyés à STAB VIDA le plus rapidement possible (maximum 5 jours après le prélèvement) Remarque: si les œufs éclosent en même temps et si vous testez plusieurs oiseaux, évitez de mélanger les coquilles d'œufs. |
Chaque échantillon doit avoir le numéro d'identification de l'oiseau ou une identification personnelle si l'oiseau n'est pas enregistré. En outre, les données relatives à vos oiseaux devraient être incluses dans la demande d'analyse ainsi que les kits de test.
Les échantillons ne doivent pas être réfrigérés mais conservés dans un endroit frais et sec; après leur collecte, ils doivent être envoyés les plus brefs délais. Veuillez noter que le colis doit inclure la demande d'analyse.
STAB VIDA n'est pas responsable des conséquences que peuvent entraîner les résultats du test. La collecte et l'envoi des échantillons incombe à chaque client.





 English
English  Español
Español  Português
Português  Nederlands
Nederlands  Deutsch
Deutsch